Nội dung ôn tập trong thời gian nghỉ học tập trung môn Hóa học 9 - Năm học 2019-2020 - Sở GD&ĐT Kon Tum
2.Tác dụng với kim loại:
Một số dd axit (HCl, H2SO4 loãng) + các kim loại đứng trước H (trong dãy HĐHH của kim loại) àmuối + H2
Vd: 2Al + 3H2SO4loãng ® Al2(SO4)3 +3H2
ØH2SO4 đặc và HNO3 tác dụng với hầu hết các kim loại tạo muối nhưng không giải phóng khí H2.
Bạn đang xem tài liệu "Nội dung ôn tập trong thời gian nghỉ học tập trung môn Hóa học 9 - Năm học 2019-2020 - Sở GD&ĐT Kon Tum", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Nội dung ôn tập trong thời gian nghỉ học tập trung môn Hóa học 9 - Năm học 2019-2020 - Sở GD&ĐT Kon Tum
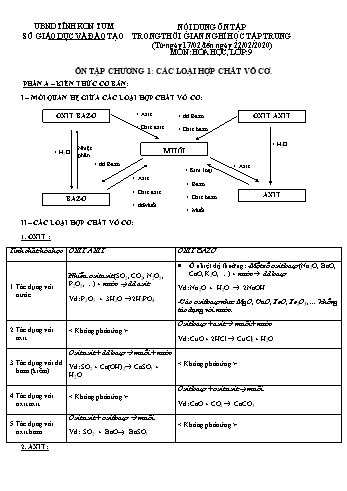
Vd: SO2 + Ca(OH)2® CaSO3 + H2O Tác dụng với oxit axit Oxit bazơ + oxit axit à muối Vd: CaO + CO2 ® CaCO3 Tác dụng với oxit bazơ Oxit axit + oxit bazơ à muối Vd: SO2 + BaO ® BaSO3 2. AXIT: Tác dụng với chất chỉ thị: Dd axit làm giấy quỳ tím chuyển sang màu đỏ. 2.Tác dụng với kim loại: Một số dd axit (HCl, H2SO4 loãng) + các kim loại đứng trước H (trong dãy HĐHH của kim loại) àmuối + H2 Vd: 2Al + 3H2SO4loãng ® Al2(SO4)3 +3H2 ØH2SO4 đặc và HNO3 tác dụng với hầu hết các kim loại tạo muối nhưng không giải phóng khí H2. Vd: Cu + 2H2 SO4đặc, nóng CuSO4 + SO2+ 2H2O 3.Tác dụng với oxit bazơ: Axit + oxit bazơ à muối + nước Vd: CaO + H2SO4® CaSO4 + H2O 4.Tác dụng với bazơ: Axit + bazơ à muối + nước (phản ứng trung hòa) Vd: 2Fe(OH)3 + 3H2SO4® Fe2(SO4)3 +6H2O 5.Tác dụng với muối: Axit + muối à muối mới + axit mới Vd: H2SO4 + BaCl2® BaSO4 + 2HCl 2HCl +Na2CO 3® 2NaCl + H2O+ CO2 ØĐiều kiện phản ứng xảy ra: Sản phẩm phải có chất không tan hoặc chất khí. 3. BAZƠ: Tác dụng với chất chỉ thị: Dd bazơ làm giấy quỳ tím chuyển sang màu xanh, dd phenolphtalein chuyển sang màu đỏ. Tác dụng với oxit axit: Bazơ tan + oxit axit à muối + nước Vd: Ca(OH)2 + SO3® CaSO4 + H2O Tác dụng với axit: Bazơ + axit à muối + nước (phản ứng trung hòa) Vd: NaOH + HCl ® NaCl + H2O Tác dụng với muối: Dd bazơ + dd muối à muối mới + bazơ mới Vd: Ba(OH) 2 + CuSO4 ® BaSO4 + Cu(OH)2 ØĐiều kiện phản ứng xảy ra: Sản phẩm phải có ít nhất 1 chất không tan. Phản ứng nhiệt phân: Bazơ không tan oxit bazơ + nước Vd: Cu(OH)2 CuO + H2 O 4. MUỐI: 1. Tác dụng với kim loại: Dd muối + kim loại à muối mới + kim loại mới Vd: Cu + 2AgNO3® Cu(NO3)2 + 2Ag ØLưu ý: Kim loại đứng trước (trừ K, Na, Ca, ) đẩy kim loại đứng sau (trong dãy HĐHH của kim loại) ra khỏi dung dịch muối của chúng. 2. Tác dụng với axit: Muối + axit à muối mới + axit mới Vd: Na2CO 3 + 2HCl ® 2NaCl + H2O + CO2 ØĐiều kiện phản ứng xảy ra: Sản phẩm phải có chất không tan hoặc chất khí. 3.Tác dụng với bazơ: Dd...ng dịch HCl, H2SO4loãng. Viết PTHH (Nếu có). Câu 4: Cho biết hiện tượng xảy ra và viết phương trình hóa học của các thí nghiệm sau: a. Cho từ từ dung dịch BaCl2 vào ống nghiệm đựng dung dịch Na 2SO4. b. Cho đinh sắt vào ống nghiệm đựng dung dịch HNO3 đặc, nguội. c. Cho lá đồng vào ống nghiệm đựng dung dịch H2SO4 đặc, đun nóng. d. Cho dung dịch NaOH vào ống nghiệm đựng dung dịch BaCl2 e. Cho lá nhôm vào ống nghiệm đựng dung dịch CuSO4 Câu 5 :Biết 40 gam hỗn hợp CaSO4, CaCO3 tác dụng vừa đủ với 800 ml dung dịch HCl thu được 2,24 lít khí (đktc). a.Tính nồng độ mol của dung dịch HCl đã dùng ? b. Tính thành phần % theo khối lượng mỗi muối trong hỗn hợp ban đầu. Câu 6: Cho 25 gam CaCO3 tác dụng vừa đủ với dung dịch HCl 14,6%. a. Viết phương trình hóa học xảy ra. b. Tính thể tích khí CO2 sinh ra ở đktc. c. Tính khối lượng dung dịch HCl 14,6% cần dùng. d. Tính nồng độ phần trăm của chất trong dung dịch sau phản ứng. Câu 7: Trung hòa 20ml dung dịch H2SO4 1M bằng dung dịch NaOH 20%. a. Viết phương trình hóa học xảy ra. b. Tính khối lượng dung dịch NaOH cần dùng. c. Nếu trung hòa dung dịch axit sunfuric trên bằng dung dich KOH 5,6%, có khối lượng riêng là 1,045g/ml, thì cần bao nhiêu ml dung dịch KOH. ------------Hết------------
File đính kèm:
 noi_dung_on_tap_trong_thoi_gian_nghi_hoc_tap_trung_mon_hoa_h.docx
noi_dung_on_tap_trong_thoi_gian_nghi_hoc_tap_trung_mon_hoa_h.docx

