Nội dung ôn tập trong thời gian nghỉ học tập trung môn Hóa học Lớp 10 - Đợt 2 - Năm học 2019-2020 - Sở GD&ĐT Kon Tum
Câu 1. Chỉ ra nội dung sai khi nói về ion?
A. Ion là phần tử mang điện.
B. Ion âm gọi là cation, ion dương gọi là anion.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử.
D. Ion được hình thành khi nguyên tử nhường hay nhận electron.
Câu 2. Chọn đáp án đúng nhất
A. Bản chất của liên kết ion là lực đẩy tĩnh điện giữa 2 ion mang điện trái dấu.
B. Bản chất của liên kết ion là lực hút tĩnh điện giữa 2 ion dương và âm.
C. Bản chất của liên kết ion là lực hút tĩnh điện giữa các hạt mang điện trái dấu.
D. Bản chất của liên kết ion là lực hút tĩnh điện giữa hạt nhân và các electron hóa trị.
Bạn đang xem tài liệu "Nội dung ôn tập trong thời gian nghỉ học tập trung môn Hóa học Lớp 10 - Đợt 2 - Năm học 2019-2020 - Sở GD&ĐT Kon Tum", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Nội dung ôn tập trong thời gian nghỉ học tập trung môn Hóa học Lớp 10 - Đợt 2 - Năm học 2019-2020 - Sở GD&ĐT Kon Tum
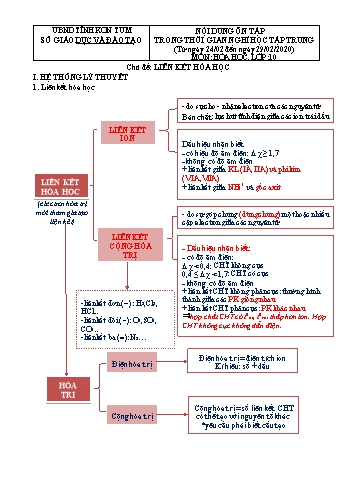
tích ion Kí hiệu: số + dấu Cộng hóa trị = số liên kết CHT có thể tạo với nguyên tố khác *yêu cầu phải biết cấu tạo -liên kết đơn () : H2,Cl2, HCl.. -liên kết đôi (): O2,SO2 , CO2.. -liên kết ba (): N2 (electron hóa trị mới tham gia tạo liện kết) 2. Số oxi hóa Quy tắc 2. Số oxi hóa (hay tổng số oxi hóa) ion bằng điện tích ion Quy tắc 1. Số oxi hóa (hay tổng số oxi hóa) đơn chất hay hợp chất đều bằng 0 Số oxi hóa (là điện tích nếu xem hợp chất là hợp chất ion) Quy tắc 3. Quy ước trong hợp chất + H : +1, + F : -1 , O : -2 (trừ một số TH: F2O, H2O2 ) + Kim loại = + hóa trị + số oxy hóa cao nhất phi kim = số thứ tự nhóm Dự đoán tính chất nguyên tố có thay đổi (trước và sau) II. VÍ DỤ MINH HỌA HÓA TRỊ Điện hóa trị Cộng hóa trị LIÊN KẾT HÓA HỌC LIÊN KẾT ION LIÊN KẾT CỘNG HÓA TRỊ - do sự cho-nhận electron của các nguyên tử Bản chất: lực hút tỉnh điện các ion trái dấu - do sự góp chung (dùng chung) một hoặc nhiều electron giữa các nguyên tử Dấu hiệu nhận biết - có hiệu độ âm điện : - không có độ âm điện + liên kết giữa KL (IA, IIA) và phi kim (VIA,VIIA) + liên giữa NH4+ và gốc axit hợp chất ion có t0nc, t0sôi cao, tan trong nước, dung dịch dẫn điện được - Dấu hiệu nhận biết: - có độ âm điện: : CHT không cực : CHT có cực - không có độ âm điện + liên kết CHT không phân cực: PK giống nhau + liên kết CHT phân cực: PK khác nhau hợp chất CHT có t0nc, t0sôi thấp hơn ion. Hợp CHT không cực không dẫn điện. (có tính định hướng, bão hòa) (không có tính định hướng, không bão hòa) Điện hóa trị = điện tích ion Kí hiệu: số + dấu Cộng hóa trị = số liên kết CHT có thể tạo với nguyên tố khác *yêu cầu phải biết cấu tạo -liên kết đơn () : H2,Cl2, HCl.. -liên kết đôi (): O2,SO2 , CO2.. -liên kết ba (): N2 (electron hóa trị mới tham gia tạo liện kết) Dạng 1: Bài tập về khái niệm cơ bản Ví dụ: Câu 1. Chỉ ra nội dung sai khi nói về ion? A. Ion là phần tử mang điện. B. Ion âm gọi là cation, ion dương gọi là anion. C. Ion có ...iên kết cộng hoá trị được tạo thành giữa những nguyên tố có tính chất gần giống nhau. B. Liên kết cộng hoá trị thường được tạo thành giữa những nguyên tử phi kim. C. Liên kết ion được tạo thành giữa hai ion có điện tích trái dấu nhau. D. Liên kết cộng hoá trị được tạo thành giữa nguyên tố kim loại điển hình và phi kim điển hình. HÓA TRỊ Điện hóa trị Cộng hóa trị LIÊN KẾT HÓA HỌC LIÊN KẾT ION LIÊN KẾT CỘNG HÓA TRỊ - do sự cho-nhận electron của các nguyên tử Bản chất: lực hút tỉnh điện các ion trái dấu - do sự góp chung (dùng chung) một hoặc nhiều electron giữa các nguyên tử Dấu hiệu nhận biết - có hiệu độ âm điện : - không có độ âm điện + liên kết giữa KL (IA, IIA) và phi kim (VIA,VIIA) + liên giữa NH4+ và gốc axit hợp chất ion có t0nc, t0sôi cao, tan trong nước, dung dịch dẫn điện được - Dấu hiệu nhận biết: - có độ âm điện: : CHT không cực : CHT có cực - không có độ âm điện + liên kết CHT không phân cực: PK giống nhau + liên kết CHT phân cực: PK khác nhau hợp chất CHT có t0nc, t0sôi thấp hơn ion. Hợp CHT không cực không dẫn điện. (có tính định hướng, bão hòa) (không có tính định hướng, không bão hòa) Điện hóa trị = điện tích ion Kí hiệu: số + dấu Cộng hóa trị = số liên kết CHT có thể tạo với nguyên tố khác *yêu cầu phải biết cấu tạo -liên kết đơn () : H2,Cl2, HCl.. -liên kết đôi (): O2,SO2 , CO2.. -liên kết ba (): N2 (electron hóa trị mới tham gia tạo liện kết) Dạng 2: Bài tập về xác định hóa trị, loại liên kết Ví dụ: Câu 1. Cho phân tử , hóa trị của Ca trong phân tử đó là A. Điện hóa trị 2+ B. Cộng hóa trị 2 C. Điện hóa trị 2- D. Điện hóa trị +2 Hướng dẫn: Điện hóa trị bằng số liên kết cộng hóa trị mà nguyên tử nguyên tố đó tạo ra được với các nguyên tử khác trong phân tử. Điện hóa trị của Ca trong phân tử là 2+. Đáp án A Câu 2. Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là , nguyên tử của nguyên tố Y có cấu hình electron lớp ngoài cùng là . Công thức phân tử của hợp chất tạo bởi X và Y có dạn...ân tử sau phân tử nào có độ phân cực lớn nhất A. . B. . C. . D. . Hướng dẫn: Hiệu độ âm điện giữa hai nguyên tử tham gia liên kết trong các phân tử: - NaCl: hiệu độ âm điện của Cl và Na là 3,16 - 0,9 = 2,26. - MgO: hiệu độ âm điện của O và Mg là 3,44 – 1,2 = 2,24. - : hiệu độ âm điện của Cl và Mg là 3,16 – 1,2 = 1,96. - : hiệu độ âm điện của O và Cl là 3,44 – 3,16 = 0,28. Hiệu độ âm điện càng lớn thì phân tử có độ phân cực càng lớn. Vậy phân tử có độ phân cực nhất là NaCl Chọn A. III. BÀI TẬP TRẮC NGHIỆM Câu 1. Nhóm hợp chất nào sau đây đều là hợp chất ion? A. H2S, Na2O. B. CH4, CO2. C. Al2O3, BaCl2. D. SO2, KCl. Câu 2. Các chất mà phân tử không phân cực là A. HBr, CO2, CH4. B. Cl2, CO2, C2H2. C. NH3, Br2, C2H4. D. HCl, C2H2, Br2. Câu 3. Dãy phân tử nào cho dưới đây đều có liên kết cộng hoá trị không phân cực? A. N2, CO2, Cl2, H2. B. N2, Cl2, H2, HCl. C. N2, HI, Cl2, CH4. D. Cl2, O2. N2, F2. Câu 4. Cho các ion: Na+, Al3+, SO42-, NH4+, NO3-, Cl-, Ca2+. Hỏi có bao nhiêu cation? A. 2 B. 3 C. 4 D. 5 Câu 5. Điện hóa trị của Mg và Cl trong MgCl2 theo thứ tự là A. 2 và 1. B. 2+ và 1–. C. +2 và –1. D. 2+ và 2– Câu 6. Trong hợp chất Al2(SO4)3, điện hóa trị của Al là A. 3+ B. 2+ C. 1+ D. 3-. Câu 7. Cộng hóa trị của Cl và O trong Cl2O7, theo thứ tự là A. 7 và 2. B. 2 và 7. C. 4 và 1. D. 1 và 2. Câu 8. Cộng hoá trị của C và N trong CH4 và NH3 lần lượt là A. 2 ; 4. B. 4 ; 3. C. 3 ; 3. D. 1 ; 4. Câu 9. Dãy chất nào sau đây chỉ chứa liên kết ion? A. K2O, BaCl2, HCl, NaCl. B. CO2, BaO, Na2O, NaCl. C. KI, Li2O, BaCl2, NaF. D. BaO, CaO, NaCl, Na2S. Câu 10. Cho các ion sau: Mg2+, SO, Al3+, S2-, Na+, Fe3+, NH, CO. Số ion đơn nguyên tử là A. 5. B. 4. C. 6. D. 3 Câu 11. Dãy các chất được xếp theo chiều tăng dần sự phân cực của liên kết? A. NaCl, Cl2, HCl. B. HCl, N2, NaCl. C. Cl2, HCl, NaCl. D. Cl2, NaCl, HCl. Câu 12. Nếu xét nguyên tử X có 3 electron hóa trị và nguyên tử Y có 6 electron hóa trị thì công thức của hợp chất ion đơn giản nhất tạo bởi X
File đính kèm:
 noi_dung_on_tap_trong_thoi_gian_nghi_hoc_tap_trung_mon_hoa_h.docx
noi_dung_on_tap_trong_thoi_gian_nghi_hoc_tap_trung_mon_hoa_h.docx

