Nội dung ôn tập trong thời gian nghỉ học tập trung môn Hóa học Lớp 10 - Chủ đề: Nguyên tử - Năm học 2019-2020 - Sở GD&ĐT Kon Tum
I. HỆ THỐNG LÝ THUYỂT
- CẤU TẠO NGUYÊN TỬ
| Tổng số proton và nơtron : A= p + n (số khối có giá trị =nguyên tử khối) |
| là khối lượng nguyên tử tính bằng đvC |
| Tổng nguyên tử khối của các nguyên tử trong chất |
|
là các nguyên tử có cùng số proton khác số nơtron (khác số khối) Ví dụ O có 3 đồng vị : |
I. HỆ THỐNG LÝ THUYỂT
- CẤU TẠO NGUYÊN TỬ
| Tổng số proton và nơtron : A= p + n (số khối có giá trị =nguyên tử khối) |
| là khối lượng nguyên tử tính bằng đvC |
| Tổng nguyên tử khối của các nguyên tử trong chất |
|
là các nguyên tử có cùng số proton khác số nơtron (khác số khối) Ví dụ O có 3 đồng vị : |
Bạn đang xem tài liệu "Nội dung ôn tập trong thời gian nghỉ học tập trung môn Hóa học Lớp 10 - Chủ đề: Nguyên tử - Năm học 2019-2020 - Sở GD&ĐT Kon Tum", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Nội dung ôn tập trong thời gian nghỉ học tập trung môn Hóa học Lớp 10 - Chủ đề: Nguyên tử - Năm học 2019-2020 - Sở GD&ĐT Kon Tum
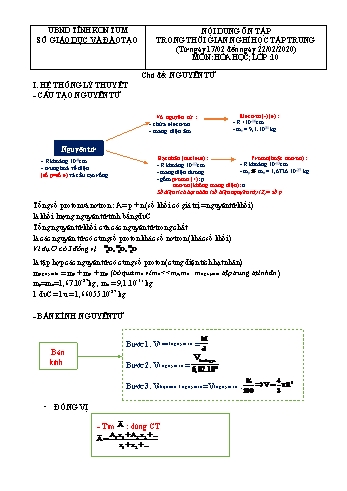
bỏ qua me vì me <<mp,mn : mnguyên tử tập trung tại nhân) mp=mn=1,67.10-27kg , me = 9,1.10-31 kg 1 đvC = 1u = 1,66055.10-27 kg - BÁN KÍNH NGUYÊN TỬ Bước 1. V1 mol nguyên tử = Bước 2. V1 nguyên tử = Bước 3. Vthực của 1 nguyên tử=V1 nguyên tử . Bán kính ĐỒNG VỊ - Tìm : dùng CT - CẤU HÌNH ELECTRON Thứ tự mức năng lượng các lớp e: 1s 2s 2p 3s 3p 4s 3d 4p Cấu hình e: biểu diễn sự phân phối các electron vào các phân lớp, lớp Cách viết cấu hình e: - phân bố các electron theo mức năng lượng (4s vào trước, 3d vào sau) - viết lại cấu hình e theo thứ tự lớp Ví dụ : 26Fe: 1s22s22p63s23p64s23d6xếp lại thứ tự: 1s22s22p63s23p63d64s2 *đặc biệt: Cấu hình e của ion : mất electron hay nhận electron từ ngoài vào trong Ví dụ: 26Fe 1s22s22p63s23p63d64s226Fe2+: 1s22s22p63s23p63d6 26Fe3+: 1s22s22p63s23p63d5 Fe3+ có 23 electron tức là Fe đã mất 3 electron Fe: 1s22s22p63s23p63d64s2 (nhớ là bỏ 2 electron vào 4s trước rồi mới bỏ số e còn lại vào 3d) II. VÍ DỤ MINH HỌA - DẠNG CẤU TẠO NGUYÊN TỬ Ví dụ 1. Tổng số hạt cơ bản trong nguyên tử X là 36, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Giá trị của ZX là A. 12 B. 10 C. 6 D. 7 - Tổng số hạt cơ bản: 2Zx + N = 36. - Số hạt mang điện nhiều hơn số hạt không mang điện là 12: 2Zx - N = 12 Giải hệ : Ví dụ 2. Tổng số hạt cơ bản của phân tử MClO3 là 182, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 58. Biết , , nguyên tố M là A. Li B. Na C. K D.Rb Theo đề Tổng số hạt cơ bạn trong MClO3=182 Số hạt mang điện nhiều hơn không mang điện : Và theo đề Ví dụ 3. Tổng số hạt trong phân tử MX là 84 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. Số nơtron của M nhiều hơn số khối của X là 4 đơn vị. Số hạt trong M lớn hơn số hạt trong X là 36 hạt. Hợp chất MX là A. CaS. B. MgO. C. MgS. D. CaO. -Tổng số hạt MX=84 -Số hạt mang diện nhiều hơn không mang điện=28 -Số nơtron của M nhiều hơn số khối của X là 4 -Số hạt của M lớn hơn số hạt của X ...à lần lượt là A. 35% và 61% B. 90% và 6% C. 80% và 16% D. 25% và 7 Bước 1. Tìm A1, A2, Theo đề : và x3 = 4% Bước 2. Đặt x1 là phần trăm của đồng vị Bước 3 Dùng CT: Ví dụ 3. Trong tự nhiên đồng có hai đồng vị là và . Nguyên tử khối trung bình của đồng là 63,54.Tính thành phần % khối lượng của trong phân tử Cu2O ? Bước 1. Tìm x1, x2 Đặt x là phần trăm đồng vị Bước 2. Dùng CT: Bước 3 Xét 1 mol Cu2O III. BÀI TẬP Câu 1: Nguyên tử khối trung bình của nguyên tố R là 79,91. Biết R có 2 đồng vị, trong đó một đồng vị là 79R chiếm 54,5% số nguyên tử. Số khối của đồng vị thứ 2 là: A. 81. B. 85. C. 82. D. 80. Câu 2: Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 4 electron. Số đơn vị điện tích hạt nhân nguyên tử của nguyên tố X là A. 12. B. 14. C. 16. D. 18. Câu 3: Nguyên tử : 1s22s22p63s23p63d64s2 có số proton và nơtron lần lượt là A. 26, 30. B. 56, 30. C. 56, 26. D. 30, 26. Câu 4: Nguyên tử X có tổng số hạt p, n, e là 36 và số khối là 24. Số lớp electron và số electron lớp ngoài cùng lần lượt là A. 3 và 2. B. 2 và 3. C. 2 và 2. D. 3 và 3. Câu 5: Số electron tối đa của lớp N là: A. 12e. B. 18e. C. 32e. D. 50e. Câu 6: Cấu hình electron nguyên tử của X là [Ar]3d54s1. Nhận định nào sau đây sai về X? A. X là nguyên tố s vì e cuối ở phân lớp s. B. X là nguyên tố d vì e cuối ở phân lớp d. C. X là kim loại vì có 1e lớp ngoài cùng. D. Số e ở phân mức năng lượng cao nhất là 5. Câu 7: Liti trong tự nhiên có 2 đồng vị là: 7Li chiếm 92,5% số nguyên tử, còn lại là 6Li. Nguyên tử khối trung bình của liti là: A. 7,00. B. 6,93. C. 6,07. D. 6,00. Câu 8: Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hóa học? A. . B. . C. . D. . Câu 9: Kí hiệu hóa học của nguyên tử là . Số hạt p, n, e trong nguyên tử này lần lượt là A. 35, 45, 35. B. 35, 80, 35. C. 45, 35, 45. D. 35, 80, 45. Câu 10: Nguyên tử R có cấu hình electron lớp ngoài cùng là 4s24p5. Điện tích hạt nhân của nguyên tử R là: A. 35. B. 25. C. 35+. D. 25+.... 19 và 8. C. 11 và 8. D. 19 và 16. Câu 16: Phân lớp nào sau đây có tối đa 10 electron? A. 1s. B. 2p. C. 3d. D. 4f. Câu 17: Nguyên tử của một nguyên tố X có lớp ngoài cùng là lớp M, trên lớp M chứa 5 electron. Cấu hình electron của X và tính chất của X là A. 1s22s22p63s 33p2, kim loại. B. 1s22s22p63s23p3, kim loại. C. 1s22s22p63s 33p2, phi kim. D. 1s22s22p63s23p3, phi kim. Câu 18: Cấu hình electron nguyên tử của nguyên tố X có Z = 15 là A. 1s22s22p63s23p5. B. 1s22s22p63s23p3. C. 1s22s22p63s23p14s2. D. 1s22s22p63s23p6. Câu 19: Nguyên tử có số hiệu nguyên tử 9 và số khối là 19. Vậy kí hiệu hóa học của nguyên tử này là A. . B. . C. . D. . Câu 20: Tổng số ba loại hạt cơ bản trong nguyên tử của một nguyên tố là 46, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14. Số hạt p, n, e của nguyên tử đó lần lượt là A. 15, 15,16. B. 16, 16, 14. C. 15, 16, 15. D. 16, 14, 16. Câu 21: Một proton mang điện tích là A. - 1,602.10-19 C B. + 1,602.10-19 C C. + 1,66.10-19 C D. - 1,66.10-19 C Câu 22: Hiđro có đồng vị và oxi có đồng vị . Có thể có bao nhiêu phân tử H2O tạo thành từ các đồng vị trên và có phân tử khối bằng 20? A. 12 B. 6 C. 9 D. 3 Câu 23: Số electron tối đa trong phân lớp s là A. 10 B. 6 C. 14 D. 2 Câu 24: Nguyên tố hoá học là những nguyên tử có cùng A. số khối B. số nơtron C. số proton và notron D. số proton Câu 25: Nguyên tử nguyên tố Al (Z = 13) có cấu hình electron là A. 1s22s22p63s23p1 B. 1s22s22p63s23p63d64s2 C. 1s22s22p63s3 D. 1s22s22p63s23p3 Câu 26: Có 4 kí hiệu . Nhận định nào sau đây là đúng? A. X, Y là hai đồng vị của nhau B. X, Z là hai đồng vị của nhau C. Y, T là hai đồng vị của nhau D. X, T có cùng số proton và cùng số nơtron Câu 27: Kí hiệu phân lớp nào sau đây là không đúng? A. 3p. B. 1p. C. 3s. D. 4d. Câu 28: Các hạt cấu tạo nên hầu hết các nguyên tử là A. electron, nơtron, proton B. electron, proton C. nơtron, electron D. proton, nơtron Câu 29: Ở trạng thái cơ bản nguyên tử của nguyên tố X có 5 electron ở
File đính kèm:
 noi_dung_on_tap_trong_thoi_gian_nghi_hoc_tap_trung_mon_hoa_h.docx
noi_dung_on_tap_trong_thoi_gian_nghi_hoc_tap_trung_mon_hoa_h.docx

